Прибор для изучения газовых законов (с манометром)
 Арт.: ФИ-5886 Стоимость: уточняйте у наших менеджеров | ||||||||||||||||||||||||||||||||||||||||||||||||
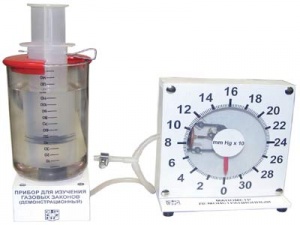
1. Назначение Прибор предназначен для демонстрации и исследования изопроцессов в газах. 2. Описание прибора Прибор (рис.1) представляет собой систему из пластмассового оцифрованного цилиндра (1) емкостью 150 мл с поршнем, помещенного в прозрачный сосуд (2), и демонстрационного манометра (3)с пределом измерения 0 — 300 мм рт.ст., соединенных между собой эластичной трубкой (4) с тройником (5) и зажимами (6 и 7). Шток поршня может принимать фиксированные положения через 20 мл общего объема цилиндра с помощью фиксатора (8) и отверстий в верхней его части и штоке. Максимальная емкость газа в замкнутой системе — 155 мл (цилиндр 150 мл + соединительные трубки и манометр 5 мл). Для проведения демонстраций необходим жидкостный термометр или электронный термометр, если цилиндр оснащен термодатчиком, и барометр-анероид. 3. Рекомендации по проведению демонстрационных опытов Закон Бойля-Мариотта (изотермический процесс) Изопроцесс — идеализированная модель реального процесса, которая только приближенно отражает действительность. Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называется изотермическим. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. В данном опыте термостатом служит атмосферный воздух, т.к. его температура заметно не меняется на протяжении всего процесса. Для проведения опыта по доказательству справедливости закона Бойля-Мариотта необходимо установить поршень по нижнему краю на отметку 150 мл при открытых зажимах, закрыть зажим, соединяющий манометр с атмосферой, получив замкнутую термодинамическую систему. Записать показания барометра-анероида и объем воздуха в замкнутой системе (157 мл). Затем давить на поршень и записывать показания приборов в таблицу:
Полученные результаты дают возможность сделать вывод, что при неизменной массе газа и постоянной температуре произведение объема газа на давление есть величина постоянная, т.е. объем газа обратно пропорционален производимому на него давлению. Закон Гей-Люссака (изобарный процесс) Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным, т.е. для газа данной массы отношение объема к температуре постоянно. Эта зависимость графически изображается прямой, называемой изобарой. Для исследования этого процесса необходимо полость цилиндра соединить с атмосферой, установить шток на делении, например, 50 мл, налить в сосуд холодную воду так, чтобы уровень ее был несколько выше кромки штока, закрыть зажим и через некоторое время замерить температуру воздуха в замкнутом объеме электронным термометром или температуру воды в сосуде жидкостным термометром. Показания температуры холодного воздуха и объем системы (в нашем случае 55 мл) занести в таблицу:
Долить в сосуд немного горячей воды, в результате чего давление воздуха в цилиндре повышается и шток поднимается. Легким движением штока установить первоначальное давление, снять показания термометра и нового объема системы. Еще раз долить горячей воды и повторить измерения, сохраняя постоянным давление в системе. Показания занести в таблицу. Взяв за начало координат первоначальные объем системы и температуру в ней воздуха, по данным в таблице вычертить график, который должен показать, что увеличение объема воздуха при нагревании на одинаковое число градусов остается постоянным. Для каждой пары измерений проверить выполнение уравнений V1/T1=V2/T2, V2/T2=V3/T3 и по уравнению d=?V/V1?T вычислить коэффициент объемного расширения воздуха при постоянном давлении. Закон Шарля (изохорный процесс) Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным, т.е. для газа данной массы отношение давления к температуре постоянно. Эта зависимость графически изображается прямой, называемой изохорой. Для исследования этого процесса необходимо полость цилиндра соединить с атмосферой, установить шток на делении 120 мл и зафиксировать его шпилькой. Налить в сосуд холодную воду так, чтобы уровень ее был несколько выше кромки штока, закрыть зажим и через некоторое время замерить температуру воздуха в замкнутом объеме электронным термометром или температуру воды в сосуде жидкостным термометром. Зафиксировать показания барометра-анероида и температуру воздуха в цилиндре. Быстро слить примерно две трети объема холодной воды и долить в сосуд горячей воды. Через некоторое время зафиксировать температуру воздуха в системе и показания манометра. Доливая горячую воду, снять показания приборов и занести их в таблицу:
Взяв за начало координат атмосферное давление и температуру холодного воздуха, по данным в таблице вычертить график, который должен показать, что увеличение давления газа при нагревании на одинаковое число градусов остается постоянным. Для каждой пары измерений проверить выполнение уравнений Р1/T1=Р2/T2, Р2/T2=Р3/T3 и по уравнению d=?Р/Р1?T вычислить термический коэффициент давления воздуха для одного-двух измерений. Его значение близко к числу 0,0036, т.е. составляет 1/273 часть первоначального давления. Объединенный газовый закон Для проверки зависимости между объемом, давлением и температурой газа используются результаты предыдущих опытов, значения которых занести в таблицу:
Пользуясь полученными результатами, вычислить значение выражения PV/T для каждого состояния и убедиться, что эти значения мало отличаются друг от друга, несмотря на значительные изменения соответствующих параметров состояния воздуха. 4. Правила эксплуатации и хранения прибора
Для более надежной работы прибора рекомендуется:
Прибор хранить в сухом отапливаемом помещении.
← Назад |




